Co by mohlo zajímat každého diabetika
Pracoviště: Klinika diabetologie, IKEM Praha
Vloženo: 3. 10. 2019
Informace z kongresu IPITA 2019
První týden v červenci 2019 se v Lyonu konal 17. světový kongres společnosti IPITA (International pancreas and islet transplant association). IPITA si klade za cíl diabetes vyléčit nebo co nejlépe kompenzovat pomocí transplantačních metod. Kongresu se zúčastnilo asi 500 vědeckých pracovníků z celého světa, kteří se vzájemně informovali o nejnovějších poznatcích v základních oborech, kterými se společnost zabývá. Těmito oblastmi jsou zejména
- orgánová transplantace pankreatu,
- transplantace izolovaných Langerhansových ostrůvků,
- léčba diabetu pomocí kmenových buněk a tkání z nich odvozených.
Pokusím se ke každému bodu shrnout, co je nyní nového. Budu se opírat nejen o konkrétní vědecká sdělení během kongresu, ale také o výsledky diskusí a o informace, které jsem pro upřesnění vyhledal.
Co a komu lze transplantovat
Inzulin se tvoří v β-buňkách pankreatu. Náhrada tkáně produkující inzulin je tedy důležitá zejména pro pacienty s diabetem 1. typu. Především jim totiž β-buňky pankreatu chybí. Je však známo, že přítomnost funkčních β-buněk je stejně důležitá i pro diabetiky 2. typu. I u nich se diabetes klinicky projevuje až v okamžiku, kdy tvorba inzulinu nestačí potřebám organismu. Transplantační metody tedy mohou být jednou důležité i pro tuto skupinu pacientů, a obecně vlastně i pro ostatní skupiny se vzácnějšími typy diabetu.
Náhradní β-buňky mohou být dodány
- ve svém původním prostředí, tedy spolu s celou slinivkou břišní,
- v Langerhansových ostrůvcích, což jsou ze slinivky v laboratoři oddělené mikroorgány,
- jako nově připravené buňky, získané z kmenových buněk, ze zvířecí tkáně nebo regenerací přirozených β-buněk.
Co by si pacienti přáli
Cílem transplantační léčby diabetu je nahradit chybějící či nedostatečně fungující β-buňky pankreatu, a zajistit tak normální či téměř normální hodnoty glykémie. Diabetikům by to nejen značně usnadnilo každodenní život a bezprostředně zlepšilo zdravotní stav, ale také by je to ochránilo před rozvojem pozdních komplikací diabetu.
Velkou komplikací dosavadních metod léčby diabetu jsou hypoglykémie, které jsou tím nebezpečnější, čím víc se kompenzace diabetu blíží normálním hodnotám. Cílem transplantací tedy také je předcházet hypoglykémiím. Transplantované či regenerované buňky by měly správně rozpoznávat nízké hodnoty glykémie a včas uvolňování inzulinu zastavit.
Na otázku, co by si pacienti sami přáli, nejčastěji odpovídají: Chtěli bychom mít od diabetu pokoj. Je nám jedno, jestli to bude pomocí injekcí, přístrojů či transplantované tkáně. Jen aby to fungovalo samo, abychom nemuseli neustále myslet na to, kolik inzulinu si máme podat, zda jsme snědli správné množství jídla, anebo jestli nám nehrozí hypoglykémie. Tyto starosti ať nosí v hlavě β-buňka. Zdravá nebo i ta transplantovaná.
Transplantace versus technologie
Podat správnou dávku inzulinu ve správný čas by teoreticky měly také zvládat dobře vymyšlené technické prostředky. Proto se transplantační metody v léčbě diabetu dlouhou dobu vyvíjely společně s nimi. Začátkem nového tisíciletí se konečně podařilo vyvinout kvalitní senzory hladiny krevního cukru v podkoží, které ve spojení s inzulinovou pumpou znamenají velký krok kupředu. Technologie získala před biologií náskok a prosadila se nejen na diabetologických sympoziích, ale také obchodně. Pacienti nyní netrpělivě čekají, kdy se konečně podaří zkonstruovat automatická zařízení do kapsy, která za ně každodenní starosti s glykémií převezmou.
Jenže taková zařízení hned tak vyvinutá nebudou. Hladiny glukózy se stále měří především v podkoží, a nikoliv v krvi. Inzulin se rovněž aplikuje do podkoží, a ne přímo do krevního řečiště. Inzulin se uvolňuje nejen po stimulaci glukózou, ale i jinými podněty. Tím vzniká nejenom zkreslení výsledků měření, ale také chyby způsobené špatným odhadem glykémie. A k tomu všemu se ještě inzulin nemusí vstřebávat pravidelně a občas z nějakého důvodu nevyvolá reakci, kterou bychom očekávali. Přirozené β-buňky pankreatu jsou naproti tomu mnohem chápavější, rychlejší, přesnější a spolehlivější.
Výhody a nevýhody
Technické a transplantační metody spolu proto nadále soutěží a vzájemně se srovnávají. Zatímco biologická náhrada, zejména formou orgánové transplantace pankreatu či transplantace ostrůvků, může fungovat téměř perfektně, technické postupy zatím takto dokonalé nejsou. Na druhé straně ale mohou být snáze dostupné. Rozvoj elektrotechniky je dnes enormní. Technické prostředky nevyžadují složitější chirurgii ani imunosupresivní léčbu. Ty současné však nedokáží rozlišovat nahodilé změny, jakými jsou např. nepravidelné vstřebávání inzulinu z podkoží či „únava senzoru“, a vyžadují neustálou pozornost a disciplinovanost. Toho mnozí pacienti nejsou v reálném životě schopni. Život je prostě změna. A když dojde na glykémie, mohli by o tom diabetici vyprávět…
Transplantace pankreatu
Tato metoda dnes představuje téměř suverénní způsob, jak obnovit u pacientů s diabetem 1. typu regulovanou sekreci inzulinu a normalizovat glykémie. Operace je bezprostředně úspěšná asi v 95 %. To znamená, že až 95 % pacientů může přerušit léčbu inzulinem, zanechat diety, odložit glukometry a zásobní balíčky glukózy ve všech kapsách pro případ hypoglykémie.
Pro každou transplantaci se ovšem musí najít vhodný dárce orgánů s mozkovou smrtí, jehož pankreas není poškozen samotným úmrtím ani předchozími chorobami. Takových dárců se v České republice objeví maximálně 70 ročně a transplantaci se podaří uskutečnit asi od 45 z nich. V některém případě slinivka nevyhovuje pro obezitu dárce, přidružená onemocnění, pokročilý věk či nevhodné cévní zásobení. V České republice je odběrový systém velmi dobře organizovaný a rovněž výběr pacientů pro tento způsob léčby je systematický. Je ale patrné, že vzhledem k počtu dárců může být transplantace pankreatu nabízena jen pro výjimečné případy diabetu. Vybírají se případy, u nichž existuje naděje na co nejlepší efekt vzhledem k rizikům, která tato operace přináší. Pochopitelně všichni příjemci musejí být po transplantaci trvale léčeni intenzivní imunosupresivní léčbou.
Komu transplantovat pankreas
Transplantace pankreatu je proto nejčastěji indikována pro nemocné s dlouho trvajícím diabetem 1. typu, kteří dospějí do stadia chronického selhání ledvin a potřebují k další léčbě transplantaci ledviny. Ti potom podstupují současně transplantaci obou orgánů (ledviny a pankreatu). Kandidáti jsou zařazováni do čekací listiny na základě podrobného vyšetření, které musí prokázat nejen vhodnost samotného výkonu, ale také nepřítomnost závažných faktorů, které by zvyšovaly jeho riziko.
Transplantace pankreatu v IKEM
V ČR se transplantace pankreatu provádějí v Institutu klinické a experimentální medicíny. Ročně sem ke stanovení indikace přichází asi 70 možných kandidátů, z nichž indikační kritéria splňuje asi 40-50. Ve většině případů je indikována kombinovaná transplantace spolu s ledvinou a jen výjimečně se plánuje samotná transplantace pankreatu. Ta je skutečně vhodná jen pro pacienty, u nichž inzulinová léčba s vynaložením všech dostupných technických pomůcek prokazatelně selhává. Zpravidla se jedná o osoby s opakovanými závažnými život ohrožujícími hypoglykémiemi. Samotný pankreas se také transplantuje diabetikům, kteří před tím podstoupili transplantaci ledviny, ať již od zemřelého či žijícího dárce.
Česká republika patří v této oblasti k nejaktivnějším a nejúspěšnějším zemím na světě. Transplantací pankreatu se provádí ročně asi 40–45, což v současné době staví naši republiku vzhledem k počtu obyvatel na 3. místo na světě za Norskem a Velkou Británií. Bezprostředně po transplantaci nepotřebuje inzulin k léčbě asi 95 % příjemců. Plná funkce pankreatu přetrvává po 5 letech u 75 % příjemců a po 10 letech u 65 % příjemců. V současné době se podaří transplantaci pankreatu realizovat u většiny osob, u nichž byl tento způsob léčby po pečlivém zvažování shledán jako vhodný.
Nedostatek orgánů
Vhodných orgánů k transplantaci je obecně velký nedostatek. Protože Langerhansových ostrůvků většinou v průběhu stárnutí ubývá a výkon β-buněk se spíše snižuje, nehodí se k transplantaci orgány od starších dárců (obecně starších 50 let). Langerhansovy ostrůvky jsou navíc velmi citlivé na poškození, ke kterému může dojít v průběhu ošetřování dárce a při odběru.
Orgány k transplantaci se většinou odebírají (po splnění náležitých zdravotnických a legislativních podmínek) osobám s nevratnou ztrátou funkce celého mozku. Pacientovi ale díky přístrojové podpoře stále bije srdce a je zajištěno prokrvení tělesných orgánů s výjimkou mozku.
K zajištění většího počtu dárců se indikační kritéria pro odběr nově rozšiřují též na dárce s kardiovaskulární příčinou úmrtí. Jedná se o nemocné s těžkým poškozením mozku, u nichž však nejsou splněna všechna stávající kritéria pro smrt mozku. Krevní oběh a dýchání jsou udržovány pomocí přístrojů, další léčba je však na základě posouzení skupiny odborníků prokazatelně marná. K odběru orgánů může dojít až po určitém období kompletní zástavy krevního oběhu. Ačkoliv se tomu odběrový tým snaží předejít, může během tohoto období dojít k určitému poškození odebíraných orgánů. Výsledky z několika center ovšem ukazují, že při správném postupu při odběru může slinivka po transplantaci fungovat stejně dobře jako při odběru od dárců se smrtí mozku. Po odběru mohou být orgány uměle promývány a zásobeny kyslíkem. Tímto způsobem by se počet dárců mohl zvýšit o 10–20 %.
Pankreas i pro diabetiky 2. typu?
Dalším trendem, zvláště v zemích, kde se nedaří zařazovat do čekací listiny dostatečný počet pacientů s diabetem 1. typu, je provádění transplantace pankreatu i u vybraných osob s diabetem 2. typu, zpravidla rovněž současně s transplantací ledviny. Také u nich může transplantovaná slinivka dlouhodobě fungovat a zajistit nezávislost na inzulinu. V praxi se ale většinou jedná o osoby, které nemají typickou inzulinovou rezistenci. Přesné určení typu diabetu je u nich často sporné, protože mají do určité míry zachovanou vlastní produkci inzulinu (pozitivní C-peptid), ale potřebují standardní dávky inzulinu. Obezita představuje riziko pro úspěch transplantace pankreatu. U nás se proto pankreas netransplantuje osobám s BMI indexem nad 30 kg/m2. Pro některá zahraniční pracoviště je ale limit až 35 kg/m2.
V České republice byla provedena transplantace pankreatu u pacienta s diabetem 2. typu jen v ojedinělých případech. A důvod? V ČR je totiž výběr pacientů s diabetem 1. typu, pro něž je tento typ transplantace vhodnější, systematicky vypracován. Spolupráce diabetologů s transplantačními chirurgy je velmi dobrá. Vhodných příjemců s diabetem 1. typu, kteří transplantaci potřebují, je proto v čekací listině dostatek.
Jak s pankreatem zítra?
Transplantace pankreatu je výkon náročný jak pro samotného pacienta, tak pro operační tým. Očekává se, že tento stále riskantní způsob léčby diabetu v budoucnu nahradí jiná transplantační metoda.
Nicméně dlouhodobé výsledky jsou zatím ze všech dostupných možností nejlepší. Omezování tohoto programu se proto v dohledné době rozhodně neočekává. Pacienti s diabetem by si však měli uvědomit, že transplantace pankreatu je výkon výjimečný a pro převážnou většinu z nich existují vhodnější a méně riskantní způsoby léčby.
Transplantace Langerhansových ostrůvků
Zatímco počet orgánových transplantací pankreatu se celosvětově blíží 50 000, transplantace izolovaných ostrůvků byla dosud provedena asi u 2 000 osob. Zavedení funkčního programu je stále náročné a v řadě zemí včetně USA není tento výkon dosud hrazen zdravotními pojišťovnami. Pro izolaci ostrůvků jsou zatím určeny pankreaty, které nesplňují přísné podmínky pro orgánovou transplantaci. Jedná se zejména o pankreaty od starších a často obézních dárců.
Limitujícím faktorem pro realizaci ostrůvkové transplantace není tedy jenom získání vhodného dárce pankreatu, ale především výsledek izolačního procesu. Ten je možné zatím hodnotit spolehlivě kvantitativně, ale ověření dobré funkce izolovaných ostrůvků ještě před transplantací je obtížné. Jednou z novinek prezentovaných českými autory je poloautomatické vyhodnocování počtu a velikosti izolovaných ostrůvků pomocí počítačového zpracování digitálních snímků získané tkáně. Program, který je schopen rozlišovat jednotlivé ostrůvky od přimíchané exokrinní tkáně, se v průběhu používání sám počítačově učí. Tím přispívá k lepšímu rozhodování, zda výsledek izolace ostrůvků bude či nebude vhodný ke klinické transplantaci. Program také umožňuje používat stejná kritéria pro hodnocení ve všech izolačních centrech, která o jeho použití požádají. Laboratoře je tak možné mezi sebou porovnávat.
Implantace ostrůvků
Implantace Langerhansových ostrůvků (zavedení do těla) je pro pacienta výrazně jednodušší a bezpečnější než orgánová transplantace pankreatu.
V současné době se ostrůvky téměř vždy podají v krátké (asi 60 minut trvající) infuzi do jaterního cévního systému. Použije se k tomu vrátnicová (portální) žíla, do které je nutné přes kůži zavést kanylu (hadičku). Ostrůvky se pak zaklíní v jaterních kapilárách a usadí se zde. Prostředí v jaterním řečišti však pro ně není ideální. Značná část podaných ostrůvků odumře (zejména pro nedostatek kyslíku) a jen část z nich přečká kritické období, než se pro ně vytvoří nové vlásečnice, které přivádějí kyslík a živiny. To trvá asi týden.
Hledají se proto výhodnější metody implantace. Jednou z nich je usazení ostrůvků mezi střevní kličky do uměle vytvořené kapsy, kterou vytvářejí úpony střeva v dutině břišní, tzv. mezenterium. Mezi kličkami se vytvoří kapsa pomocí dvou listů mezenteria, kam se mohou ostrůvky uložit do speciálního gelu, který současně takto vytvořenou kapsu „slepí“. Gel se tvoří pomocí krevní plazmy, která se pacientovi před implantací odebere a uchová se ve zmraženém stavu. Před transplantací se plazma rozmrazí a smíchá s ostrůvky. Poté se v plazmě aktivuje srážení (tuhnutí) a ve vzniklém gelu se ostrůvky uloží mezi listy mezenteria. Srážením krevní plazmy se listy mezenteria slepí a ostrůvky zůstanou na správném místě, do kterého by měly dobře pronikat živiny a kyslík, a naopak by se odsud měl dobře uvolňovat inzulin. Tato metoda byla již odzkoušena u experimentálních zvířat a nyní je připravena ke klinickému použití také v pražském IKEM.
Příprava ostrůvků k transplantaci
Příprava ostrůvků k transplantaci vyžaduje multidisciplinární spolupráci. Nejprve chirurgický tým odebere slinivku břišní z těla zemřelého dárce a odešle ji do izolační laboratoře, která musí splňovat náročné podmínky na čistotu práce. Tým tří až čtyř zacvičených osob nejprve zavede do pankreatického vývodu enzym kolagenázu, který oddělí jednotlivé ostrůvky od převažující části pankreatu, kde se tvoří zažívací šťávy. Ostrůvky jsou potom čištěny a koncentrovány v buněčném separátoru a jsou uloženy do tkáňové kultury až do chvíle, kdy je příjemce připraven k implantaci. V ostrůvkové laboratoři v IKEM se takto zpracuje ročně asi 30 pankreatů. Přibližně v polovině případů je izolace po všech stránkách úspěšná a ostrůvky se mohou použít k transplantaci. Podobných laboratoří je v Evropě asi 15. Bohužel požadavky na čistotu pracoviště podle mezinárodních norem rostou rychleji než finanční zdroje potřebné pro jejich realizaci.
Výsledky ostrůvkových transplantací
Efekt ostrůvkové transplantace zatím není stejně impresivní jako orgánová transplantace pankreatu a zdaleka ne ve všech případech se podaří dosáhnout úplné nezávislosti na injekčním podávání inzulinu. V současné době jsou hlavním důvodem k provedení ostrůvkové transplantace opakované život ohrožující hypoglykémie. Ty jsou způsobeny poruchou kontraregulačních reakcí, které by měly nejen zmobilizovat krevní cukr z jiných zdrojů v těle, ale také pacienta upozornit, že se hypoglykémie rozvíjí. Tento stav se označuje jako porucha vnímání hypoglykémie. Pochopitelně je nutné vyloučit případy, kdy za častými hypoglykémiemi stojí nedostatečná disciplína pacienta či špatně nastavený způsob inzulinové léčby.
Pro definici úspěchu byla během kongresu přijata kritéria, která se opírají nejen o míru kompenzace diabetu, ale také o to, zda se transplantací podaří odstranit syndrom nerozpoznávání hypoglykémií. Výsledek transplantace se vyjadřuje pomocí 4stupňové klasifikace. Tato klasifikace je také vhodná k tomu, abychom mohli metodu porovnávat s výsledky, kterých dosahujeme s použitím moderních technických prostředků, jakými jsou pumpy a senzory.
|
Hodnocení funkce ostrůvků |
Glykovaný hemoglobin (mmol/mol) |
Těžké hypoglykémie |
Potřeba inzulinu (j/kg/den) |
Hladina C-peptidu |
Hodnocení léčebného úspěchu |
|
optimální |
pod 48 |
žádné |
žádná |
vyšší než dříve |
úspěch |
|
dobrá |
pod 53 |
žádné |
pod 50 % původní dávky |
vyšší než dříve |
úspěch |
|
hraniční |
jako dříve |
méně než dříve |
nad 50 % původní dávky |
vyšší než dříve |
spíše neúspěch |
|
selhání |
jako dříve |
jako dříve |
jako dříve |
0 či jako dříve |
neúspěch |
Za výborný (optimální) výsledek se považuje velmi dobrá kompenzace diabetu, eliminace hypoglykemických stavů, snížení dávky inzulinu pod 50 % původní dávky. Pochopitelně je vždy nutné přihlížet k možným nežádoucím účinkům imunosupresivní léčby, kterou je nutné trvale užívat. U některých pacientů i tzv. hraniční funkce ostrůvků může mít určitý klinický přínos pro zmírnění hypoglykémií a zlepšení stability.
Kmenové buňky pro léčbu diabetu
Celý lidský organismus se vyvine z jediné ženské pohlavní buňky (vajíčka), která se po oplodnění mužskou pohlavní buňkou (spermií) začne rychle dělit. Všech do současné doby známých asi 270 typů tělesných buněk se během embryonálního vývoje postupně vyvine z této jediné buňky.
Již po několika dnech od oplodnění se začnou různé skupiny buněk od sebe lišit a postupně se specializují. Čím jsou specializovanější, tím méně jsou později schopné se přeměňovat na jiné typy. Nakonec mluvíme o tzv. definitivně předurčených buňkách, které už mohou sloužit jen určitému přesnému účelu. Některé z nich se mohou dále množit, jiné už ani to ne a zbývá jim jen „pracovat“.
Naštěstí existují i tzv. dospělé kmenové buňky. Ty se množit mohou, ale dále se specializují jen určitým směrem. Slouží k průběžné renovaci a k hojení. Bohužel lidské β-buňky se tímto způsobem téměř neobnovují. Čeká je pouze těžká celoživotní práce: vyrábět vzhledem k píli jiných buněk v organismu enormní množství jedné látky - inzulinu. A tak není divu, že v průběhu života se některé z nich unaví, nebo dokonce zaniknou. A protože se nedovedou bránit, podléhají snadno autoimunitnímu poškození (jak je tomu u diabetu 1. typu) nebo přetížení (jak je tomu u diabetu 2. typu).
Diferenciace
Proces specializace (diferenciace) jednotlivých buněk je v organismu velmi přesně regulovaný. Jednotlivé buňky přitom na sebe vzájemně působí v přesném časovém sledu. Některé jejich schopnosti trvají jen přechodně (třeba i pouhé hodiny) a končí dosažením dalšího vývojového stadia. Uvolňují do svého vlastního jádra, ale i do okolí různé regulační bílkoviny a malé molekuly, které přesně řídí další vývoj zárodku.
Základy lidských Langerhansových ostrůvků jsou v pankreatu vytvořeny asi za 7 týdnů po početí. Po určitou dobu pak ještě mohou β-buňky dále vznikat postupnou diferenciací nebo množením, ale tento proces je téměř ukončen brzy po narození. V malé míře sice může být prokazatelný po celý život, avšak k obnově poškozených či zaniklých β-buněk to rozhodně nestačí.
Vývoj β-buněk ve zkumavce
Postupný vývoj kmenových buněk až do stadia β-buňky v embryu už vědci velmi dobře popsali. Zrodil se tak lákavý nápad tento vývoj napodobit ve zkumavce. Na konci by takto vzniklé β-buňky měly umět produkovat inzulin stejně dobře jako ty přirozené. Mohli bychom je tedy vyrábět v dostatečném množství na přání.
Vědci zkoušeli nejrůznější kombinace faktorů v různém časovém sledu a byli úspěšní. V řadě laboratoří se podařilo získat linie, které alespoň trochu inzulinu vytvářejí. Výchozích bodů bylo několik.
- Tzv. pluripotentní kmenové buňky z embrya jsou schopné téměř neomezeného množení a mohou se přeměnit v nejrůznější typy.
- Zvolíme-li tzv. multipotentní buňky, můžeme mít cestu snazší, protože ty už do určité míry samy vykročily ve své diferenciaci požadovaným směrem.
- Tzv. progenitorové buňky jsou přítomné i v dospělém organismu. Mohou se množit a dále diferencovat určitým směrem, ale pouze na jeden nebo jen několik typů buněk, například na endokrinní buňky pankreatu.
iPS buňky
Podařilo se také odebrat již zralé buňky dospělého organismu a pomocí manipulace v tkáňové kultuře je vrátit do stadia připomínajícího pluripotentní kmenové buňky, tzv. iPS (indukované pluripotentní kmenové) buňky. Jejich potenciální výhodou je, že pocházejí z těla téhož člověka, pro kterého by mohly být po příslušné diferenciaci léčebně použity. Při transplantaci by tedy nemusela být používána imunosupresivní léčba.
Další možnosti
Nabízejí se ještě 3 další možnosti. Ačkoliv se β-buňky v dospělosti již téměř nemnoží, v laboratoři by se nám to podařit mohlo. Dalším zdrojem by mohl být nějaký vývojově příbuzný orgán, třeba játra, která s pankreatem mají dlouho společný vývoj. Molekulárněbiologickým zákrokem by se mohla podařit jejich tzv. transdiferenciace. Zárodečnou tkáň lidského pankreatu se také podařilo připravit v těle některých zvířat. Vývoj jejich vlastního pankreatu byl zablokován a místo toho byly použity lidské embryonální kmenové buňky. V těle zvířete, např. prasete, by tak mohl vzniknout lidský pankreas.
Jak je příprava náhradních β-buněk daleko
Pro vývoji léčebného produktu, který by nahradil přirozené lidské β-buňky, je nutné zvládnout několik po sobě jdoucích stadií. Ta jsou podobná jako při vývoji jiných léčebných prostředků, je to jenom opravdu složité. Protože se ale jedná o zdraví, musí být konečný výrobek spolehlivě testovaný. Jeho příprava musí splňovat dnes již mimořádně náročné normy pro bezpečnost. A konečně, protože se bude jednat o produkt velmi nákladný, musí být vysoká pravděpodobnost, že se jeho výroba v dnešním komerčním světě vyplatí. Pacienti o něj budou stát a ze svého zdravotního pojištění budou schopni zpětně uhradit jeho vývoj a následující výrobu.
Představovat si můžeme 3 vývojová stadia: stadium výzkumného projektu, stadium přípravy ověřeného produktu a stadium použití a úhrady (komercionalizace).
Výzkumný projekt
Na začátku projektu stojí sen: z jedné oplodněné buňky se vyvine celý lidský organismus, tedy i β-buňky tvořící inzulin. Když to dokáže příroda, mělo by se to podařit i vědcům v laboratoři. Jenomže příroda k tomu potřebovala stovky miliónů let! Na druhé straně, vědec zase může od přírody opisovat. Jak je patrné z článků v novinách, snít umíme, a často pouze pro zábavu čtenářů. Pacienti se pak jenom diví, proč jim sny převedené do reality ještě nikdo nenabízí.
V dalším kroku je nutné zvolit vhodný buněčný zdroj a vypracovat experimentální protokol pro množení a diferenciaci. Postup je nutné spolehlivě ověřit, abychom při jeho opakování dostali vždy stejné výsledky. Výsledná buněčná linie musí být stabilní, to znamená, že pracně získané vlastnosti zase neztrácí a že se nepřeměňuje v buňky jiné, které by případně mohly být i nebezpečné. Požadavkem je, aby získané buňky správně reagovaly na koncentraci glukózy a aby přežívaly v organismu při experimentální transplantaci.
Právě do tohoto stadia se již dostala řada výzkumných skupin ve světě. Bylo tedy prokázáno, že nápad může fungovat, ale zdaleka ještě nebylo ověřeno, že lze takto léčit diabetes. Spolehlivě, dlouhodobě a bezpečně.
Příprava léčebného produktu
Ta již vyžaduje značnou dávku sebedůvěry a také důvěru od investorů. Navržený postup zdaleka nemusí stačit a může být nutné ho vylepšovat. Vlastnosti všech použitých buněčných zdrojů musí být spolehlivě definovány. Pravděpodobně nebudou stačit jenom nové β-buňky, ale také další složky Langerhansových ostrůvků, aby buňky dobře přežívaly a správně fungovaly. Nejedná se jenom o buňky endokrinní, ale také vazivové a cévní, aby dohromady lépe napodobovaly Langerhansovy ostrůvky. Ty pak mohou být transplantovány přímo, nebo chráněné v uměle vytvořených komůrkách, čemuž se říká bioarteficiální pankreas. Následují nová a nová zkoušení a v případě úspěchu podrobná definice konečného produktu. Ten musí mít předepsané vlastnosti, které je možné doložit. Jedním z požadavků také je, aby se transplantovaly jen buňky, které už nemají pluripotentní potenciál, a neměly by se tedy po transplantaci měnit na nežádoucí a nebezpečné typy.
Do tohoto stadia v současné době pokročily snad jen 2 výzkumné společnosti, avšak skutečné klinické zkoušky ještě nezačaly. Cílem zatím nebude vyléčit diabetes. Nejprve bude nutné posoudit krátkodobou bezpečnost a schopnost alespoň částečně skutečně produkovat inzulin.
Komercionalizace
V této fázi by měl již existovat funkční produkt splňující deklarované vlastnosti. Bude určen způsob použití, účel a vhodný okruh pacientů. Použití se bude opírat o úspěšné klinické studie s průkazem kvality. Musí být stanovena přijatelná finanční strategie, aby se výroba vyplatila nebo alespoň nebyla ztrátová, a produkt musí být chráněn potřebnými patenty.
Jenom pro informaci, vývoj nového perorálního antidiabetika trvá dnes od prvních farmakologických studií až po zavedení do léčby asi 10 let. Použití živých buněk k léčbě onemocnění se řadí do nové terapeutické skupiny, tzv. „pokročilých léčebných lékařských výrobků“. I když např. v onkologii se některé již s úspěchem používají, jejich bezpečnostní posuzování, zvláště u onemocnění, která bezprostředně nevedou ke smrti, se stále ještě vyvíjí.
Jak daleko tedy ve skutečnosti jsme?
Několik výzkumných skupin již dovedlo svůj projekt (stadium 1) do úspěšného stadia a předložily o tom přesvědčivé důkazy. Mezi ně se může skromně řadit skupina v IKEM, vedená Tomášem Koblasem, které se podařilo přeprogramovat určité typy buněk z pankreatických vývodů na buňky produkující inzulin. Větší potenciál možná bude mít jejich metoda pro navození proliferace (množení) přirozených buněk, které se jinak téměř nemnoží.
Téměř každý týden se objevují publikace navrhující nová řešení. Jenom minimum z nich je však skutečně věrohodných, a jak jsme již zmínili, „reprodukovatelných“.
Ve 2. stadiu (příprava léčebného produktu) se nachází zatím pouze několik výzkumných skupin. V další kapitole zmíníme některé firmy zaměřené na výzkum v této oblasti. Z nich zatím pouze dvě (Semma Therapeutics a ViaCyte) již provedly první testy u osob s diabetem a chystají se v testování pokračovat v roce 2020. Nebudeme se věnovat projektům, které z pohledu naší medicíny a lékařské legislativy nelze považovat za věrohodné. Takových je bohužel poměrně hodně.
Do stadia ověřování hotového produktu a komercionalizace nedospěla zatím žádná skupina na světě. Jinými slovy, „náhradní β-buňky“ pro léčbu diabetu pacienti zatím nemají a v průběhu následujících minimálně 2–3 let mít nebudou.
Firmy plánující vývoj léčebného produktu (stadium 2)
ViaCyte, San Diego, USA: Na základě detailního studia embryonálního vývoje pankreatu byl spolehlivě popsán postup, který vede ke vzniku zárodečných buněk, z nichž se později vyvíjí pankreas. Tyto buňky se podařilo dostatečně namnožit, charakterizovat a připravit pro pozdější použití ve zmrazeném stavu. Po rozmrazení se buňky transplantují pro zajištění bezpečnosti v uzavřených plochých komůrkách (Encaptra). Do budoucna se uvažuje též o implantaci bez ochranného pouzdra (Encaptry), a tudíž za použití imunosupresivní léčby. Zařízení Encaptra se také dále vyvíjí. Zkoušení je nyní přerušeno a bude pravděpodobně obnoveno v roce 2020 po ověření vylepšených produktů.
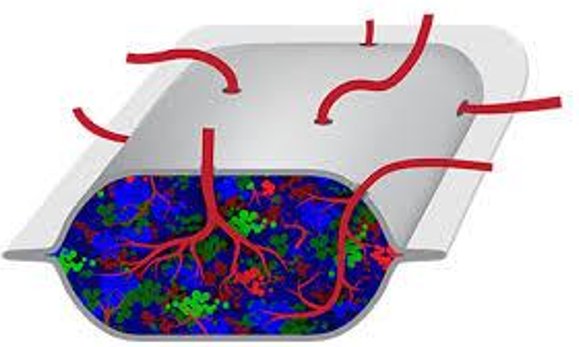
Obrázky: Inzulin produkující buňky v zařízení Encaptra od firmy ViaCyte (do komůrky se dostávají krevní cévy – červeně; inzulin produkující buňky jsou znázorněny zeleně), druhý obrázek znázorňuje celkový pohled na komůrku.
Semma Therapeutics, Boston, USA: Stejně jako v předchozím případě jsou základním zdrojem lidské embryonální kmenové buňky získané z nadbytečných vajíček připravovaných pro umělé oplodnění. Postupy se opírají o celoživotní výzkum skupiny vedené Douglasem Meltonem v Massachusetts. Ačkoliv sami autoři postupy dále vylepšují, v současné době se připravují dvě pilotní klinické studie, zatím v USA. Z tzv. pluripotentních buněk se v průběhu diferenciace podle specifických vlastností oddělují ty buňky, které tvoří základ budoucího endodermu, tedy jedné ze tří základních vývojových linií embrya. Právě endoderm se později stává základem pro vznik struktur zažívacího traktu včetně pankreatu. Při další diferenciaci jsou pak podobným způsobem odlišeny buňky, jež mají v budoucnu dát vznik pankreatu. Opět podle dalších nově získaných znaků jsou další buňky odděleny a z nich jsou pak připraveny budoucí zárodečné buňky pro endokrinní část pankreatu. Z těchto tzv. progenitorových buněk mohou vzniknout β-buňky produkující inzulin, ale také α-buňky tvořící glukagon, δ-buňky tvořící somatostatin, PP-buňky tvořící pankreatický polypeptid a ε-buňky, které uvolňují ghrelin. Všechny tyto endokrinní buňky jsou součástí Langerhansových ostrůvků.
Firma Semma Therapeutics ze směsi těchto buněk připravuje mikroskopické orgány připomínající přirozené Langerhansovy ostrůvky.
Experimenty u zvířat prokázaly jejich relativní bezpečnost a schopnost vytvářet inzulin. V experimentech u myší nedochází k nežádoucím přeměnám charakteru buněk, zejména ve smyslu přeměny na buňky potenciálně nádorové.
Nyní jsou v reálné přípravě dvě studie. U první z nich by takto v laboratoři připravené „Langerhansovy ostrůvky“ byly transplantovány podobným způsobem, jak se to zatím dělá u ostrůvků získaných z pankreatu zemřelých dárců orgánů. Protože se stále jedná o cizorodý materiál (odvozený od oplozeného vajíčka), pochopitelně bude také nutná imunosupresivní léčba. Tato studie by mohla být zahájena v USA v průběhu roku 2020. Předpokládá se, že se jí bude účastnit až 45 osob s diabetem 1. typu. Jejich zařazování do studie bude probíhat postupně tak, aby alespoň krátkodobě mohla být testována bezpečnost a účinnost vždy u několika osob, než se postoupí dále.
V přípravě je také druhá studie, u které by se podobné ostrůvky nejprve ukládaly do malých, několikacentimetrových zařízení, která by znemožňovala přímý kontakt cizorodé tkáně s buňkami příjemce. Proto se nebude muset podávat imunosupresivní léčba. Stejně jako v případě produktu firmy ViaCyte bude nutné zajistit pro implantované komůrky zásobování kyslíkem. I tato studie by mohla být zahájena ještě v roce 2020.
Produkční laboratoře se nacházejí v Bostonu, ale výrobní technologie by v případě úspěchu mohla být přenesena i do Evropy tak, aby čerstvá inzulin produkující tkáň byla snáze dostupná. Reakce uměle připravených „ostrůvků“ na podání glukózy není zatím v laboratorním prostředí dostatečná. Předpokládá se, že jejich funkční kapacita se v prostředí živého organismu postupně vytrénuje.

Douglas Melton, spoluzakladatel Semma Therapeutics, který celý život zasvětil přípravě inzulin produkujících buněk z kmenových buněk.
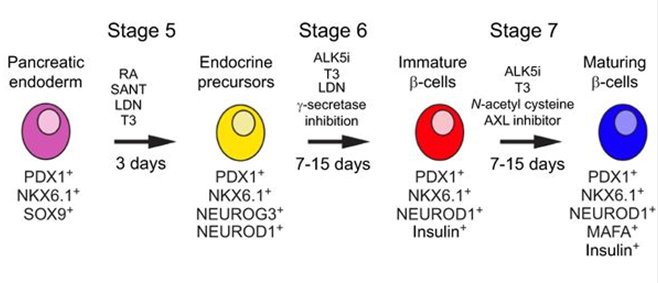
Zjednodušené schéma vývoje lidské β-buňky, které se vědci snaží napodobit v laboratoři.
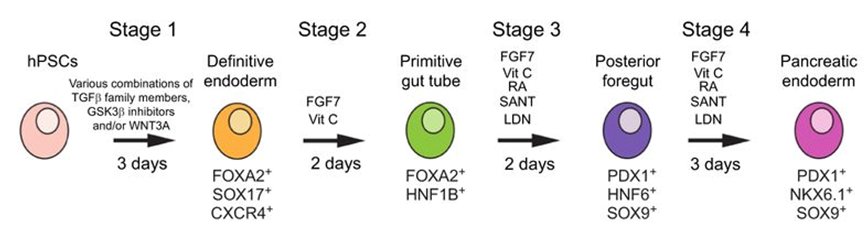
Poračování vývoje lidské β-buňky.
Seraxis, Maryland, USA: Tato firma sídlící v Miami ohlásila vývoj vitálních ostrůvků odvozených z tzv. indukovaných pluripotentních kmenových buněk (iPS buněk, viz výše). Produkt je rovněž určený k uložení do větších komůrek (SeraGraft) a v této formě má zatím název SR-01. U lidí dosud nebyl testován.
Unicyte AG (Univerzita v Turíně, Fresenius Medical Care): Tato firma vyvinula metodu pro vývoj endokrinních, a především inzulin produkujících buněk z jaterních kmenových buněk (HLSC). K jejich přeprogramování vyvinuli vlastní technologii založenou na použití nanovezikul obsahujících regulační molekuly ribonukleových kyselin (RNA). U lidí nebyl produkt zatím testován.
Sernova Corp., Kanada: V této firmě vyvinuli zařízení z plastické síťoviny (Cell Pouch), které se implantuje pacientovi do břišní stěny před plánovanou transplantací ostrůvků. Po přihojení tohoto implantátu se mají ostrůvky umístit do připravených dutin v ochranném zařízení. Bohužel, na rozdíl od experimentů u zvířat tato metoda zatím nefungovala dostatečně u několika pacientů s diabetem a ostrůvky postupně zanikly pro nedostatečný přístup kyslíku.
Buněčný „vak“, který se implantuje do podkoží. Poté, co do jeho povrchu vrostou krevní cévy, se do dutin ve vaku implantují izolované Langerhansovy ostrůvky.
Βetalin Therapeutics, Ramat Gan, Izrael: Tato firma ohlásila vývoj tzv. uměle připraveného mikropankreatu (Engineered Micropancreas - EMP), do kterého se ukládají izolované Langerhansovy ostrůvky, aby po transplantaci lépe přežívaly. Tím by k úspěchu mohl postačovat jejich menší počet. : Podkožní implantace bioarteficiálního pankreatu, ostrůvky či buňky
Buněčné lešení, do kterého se ukládají izolované Langerhansovy ostrůvky. V novém prostředí ostrůvky mohou fungovat lépe, než když se přímo implantují do jater.
AltuCell, USA, Itálie: Firma vyvíjí technologii pro použití enkapsulovaných prasečích tzv. Sertoliho buněk (podpůrné buňky pro vývoj spermií, které mají imunomodulační a metabolický efekt) v léčbě diabetu 2. typu. Podobný systém by eventuálně mohl být vhodný i pro léčbu typu 1.
NextCell Pharma AB, Stockholm, Švédsko: Probíhá klinická studie s použitím tzv. mezenchymových kmenových buněk získaných z pupečníku novorozenců pro léčbu časného stadia diabetu 1. typu. Klinický efekt zatím není známý.
Mezenchymové kmenové buňky získané z lidského pupečníku. Potenciálně se mohou přeměnit v řadu jiných typů buněk. Hojně se dnes používají v regenerační medicíně.
Osiris Therapeutics: Firma vyvinula produkt Prochymal obsahující mezenchymové kmenové buňky z kostní dřeně. Přípravek se používá v léčbě některých hematologických onemocnění. Zkoušel se také v léčbě časných stadií diabetu 1. typu, pravděpodobně bez efektu.
Mesoblast Ltd.: Firma se zabývá produkcí mezenchymových progenitorových buněk, které by mohly mít modulační efekt na průběh diabetu 2. typu, případně diabetické nefropatie.
Mezenchymové kmenové buňky dnes nacházejí široké uplatnění v regenerativní medicíně a v léčbě některých autoimunitních a degenerativních onemocnění. Jejich působení často spočívá v nespecifickém tlumení zánětlivých procesů. Jejich výhodou je, že ačkoliv pocházejí z geneticky nepříbuzných jedinců, samy o sobě nevyvolávají imunitní odpověď a spíše ji tlumí. To dovoluje připravit za standardních podmínek přesně definovaný léčebný produkt, který pak splňuje náročné podmínky pro přípravu pokročilých lékařských produktů.
Evotec a Sanofi: Firmy společně vyvíjejí metodu pro tvorbu funkčních inzulin produkujících ostrůvků z lidských indukovaných pluripotentních iPS buněk.
Orgenesis, USA: Firma vyvinula postup pro transdiferenciace jaterních buněk na buňky produkující inzulin. Předpokladem je, že pacient podstoupí ambulantně jaterní biopsii. Z odebraného vzorku se izolují jaterní buňky, které se během 5 týdnů namnoží, transdiferencují a vytvoří mikroorgány připomínající ostrůvky. Ty by se měly transplantovat obdobně jako ostrůvky od zemřelých dárců orgánů. Metoda nebyla zatím klinicky zkoušena.
Novo Nordisk (ve spolupráci s univerzitou v San Franciscu): Tato významná firma vyrábějící pro diabetiky především inzulin se nyní zaměřila také na postup získání inzulin produkujících buněk z lidských embryonálních kmenových buněk.
Eli Lilly ve spolupráci se Siglion: Také tento významný producent inzulinu zahájil vývoj zařízení, která by měla obsahovat inzulin produkující buňky odvozené z iPS buněk, které by měly být uloženy do zařízení Afibromer, aby se nemusela podávat imunosupresivní léčba. Klinické zkoušení je zatím daleko.
Beta-02, Izrael: Tato firma vyvíjí implantovatelná zařízení, ve kterých lze uložit izolované Langerhansovy ostrůvky (nebo i jejich náhrady) do podkoží. Tato zařízení mohou být různým způsobem zásobena kyslíkem, aby se zlepšilo přežívání implantovaných buněk. Proběhly již první klinické pokusy, ale produkt zatím není připraven k léčebnému použití.
PharmaCyte: Tato firma plánuje výrobu bioarteficiálního pankreatu s obsahem transdiferencovaných geneticky modifikovaných jaterních buněk (tzv. Melligen buňky), či případně i jiných typů buněk metodou, kterou označuje jako „Cell-in-a-Box technologie“ (buňky v krabici).