Interakce metforminu
Pracoviště: DrugAgency, a.s., Klokotská 833/1a, 142 00 Praha 4 Libuš
Vloženo: 2. 10. 2019
Úvodní informace
Metformin je základní a v podmínkách ČR nejčastěji užívané antidiabetikum, neboť se dle aktuálních národních doporučených postupů jedná o léčivo volby u diabetiků 2. typu. Metforminem bylo podle údajů ÚZIS v roce 2015 léčeno 498 tisíc diabetiků (tj. více než 53 % všech diabetiků). Absolutní spotřeba metforminu dle údajů SÚKL činila v roce 2017 více než 34 DDD/TID, přičemž 27,9 DDD/TID připadalo na monokomponentní metformin a 6,10 DDD/TID na jeho fixní kombinace s jinými antidiabetiky. Důvodem tohoto postavení metforminu je především jeho příznivý vliv na prognózu nemocných. Ve studii UKPDS[1] došlo u pacientů léčených metforminem ke snížení mortality související s diabetem o 42 % (9-63 % na 90% hladině spolehlivosti, p=0,017) a snížení mortality ze všech příčin o 36 % (9-55 % na 90% hladině spolehlivosti, p=0,011). Meta-analýza zahrnující celkem 35 studií prokázala v případě monoterapie metforminem oproti placebu snížení mortality o 21 % (2-36 % na 90% hladině spolehlivosti, p=0,031)[2].
Metformin je z chemického hlediska velmi jednoduchá molekula, která nepodléhá biotransformaci. Z organismu se vylučuje v nezměněné podobě, a to prakticky úplně močí. Metformin je však substrátem řady transportních systémů, které jsou odpovědné za jeho vstřebávání, rozsáhlou distribuci v organismu a za jeho eliminaci. Inhibice a indukce těchto transportních systémů[3] může mít vliv na biologickou dostupnost metforminu (a tím i jeho gastrointestinální toleranci), jeho průnik do jater a svalové buňky (a tím i účinek) a jeho eliminaci (a tím i výskyt nežádoucích účinků, zejména výskyt laktátové acidózy). Inhibice a indukce transportních systémů zajišťujících transfer metforminu do buněk a jeho eliminaci je tak hlavním mechanismem lékových interakcí metforminu.
|
metformin |
||
|
substrát |
SERT, PMAT, CHT |
|
|
OCT1, OCT2, OCT3 |
||
|
OCTN1 |
||
|
MATE-1, MATE-2K |
Tabulka č. 56 Vlastnosti metforminu jako substrátu transportních systémů |
|
|
slabý inhibitor |
P-glykoprotein |
|
Lékové interakce vzniklé v důsledku inhibice vstřebávání metforminu
Vstřebávání metforminu se děje převážně aktivním transportem[4]. Schematicky je vstřebávání metforminu uvedeno na obrázku č. 44. Na apikální straně enterocytu je za vstřebávání metforminu odpovědná čtveřice transportérů, a to OCT3 (Organic Cation Transporter), SERT (serotoninový transportér), PMAT (transportér monoaminů) a CHT (cholinový transportér), jejich podíl na vstřebávání metforminu je přibližně 2:2:2:1. Na basolaterální straně enterocytu je za vstřebání metforminu zodpovědný transportér OCT1. Genetický polymorfismus OCT1 nebo podávání inhibitorů OCT1 zvyšuje riziko intolerance metforminu[5],[6].
Zhoršení gastrointestinální tolerance metforminu je obvykle důvodem pro předčasné ukončení terapie. Projevuje se zejména jako zvýšení výskytu nevolnosti, zvracení, bolesti břicha, průjmu a nechutenství. Zhoršení gastrointestinální tolerance metforminu může být způsobeno inhibitory OCT1, jejichž současné podávání způsobuje neúplné vstřebávání metforminu v tenkém střevě a vyloučení jeho vyššího množství stolicí. Mezi středně silné až silné inhibitory OCT1 patří:
- spironolakton,
- verapamil,
- doxazosin,
- desipramin,
- propafenon,
- chlorpromazin,
- kodein,
- citalopram.
Mezi slabé inhibitory OCT1 patří:
- PPI,
- tramadol,
- amilorid,
- trimetoprim,
- estradiol,
- ondansetron,
- olaparib,
- krizotinib.
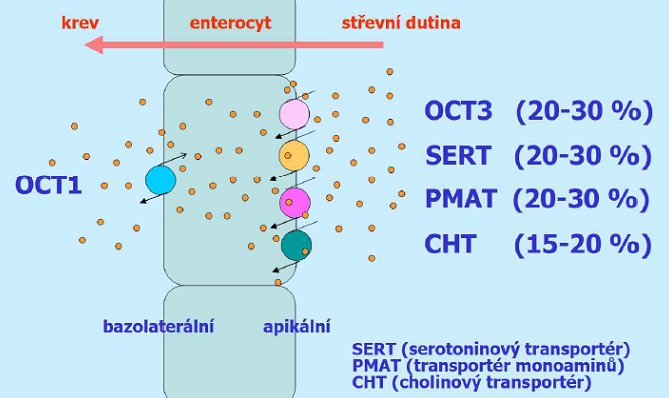
Obrázek č. 44
Schéma role jednotlivých transportních systémů při vstřebávání metforminu v trávicím ústrojí
Riziko předčasného ukončení terapie metforminem pro nežádoucí účinky vzniklé jako důsledek lékové interakce metformin - inhibitory OCT1 je relativně vysoké a činí 1,64 (1,20-2,25 na 95% hladině spolehlivosti), přičemž toho riziko bylo mírně vyšší v případě inhibitorů protonové pumpy, kde dosahovalo 1,84 (1,32-2,57 na 95% hladině spolehlivosti)5. Ještě vyšší riziko pak bylo zjištěno pro silné inhibitory OCT1 jako jsou citalopram (3,22 s rozptylem 1,08-9,60 na 95% hladině spolehlivosti), kodein (4,03 s rozptylem 1,37-11,90 na 95% hladině spolehlivosti), respektive verapamil (7,44 s rozptylem 2,09-26,50 na 95% hladině spolehlivosti).
Je tedy zřejmé, že současné podávání inhibitorů OCT1 pacientům léčeným metforminem, zejména při zahajování terapie metforminem je krajně nevhodné a je vhodné se mu vyvarovat.
Lékové interakce vzniklé v důsledku inhibice transportu metforminu
Metformin je dále substrát OCT2, OCTN (Organic Cation Transporter, Novel) a MATE (Multidrug And Toxin Extrusion protein)3. Transportní systémy OCT mají obdobnou expresi (enterocyt, játra, ledviny) avšak mají ve vztahu k metforminu odlišné funkce (vstřebávání, stup do jaterní, svalové a ledvinové buňky). Transportní systémy MATE mají odlišnou expresi, ale ve vztahu k metforminu totožnou funkci (eliminaci ledvinami).
Role OCT2 je zásadně významná pro zajištění eliminace metforminu. Metformin v první fázi eliminace vstupuje do tubulární buňky ledvin výhradně cestou OCT23. Inhibice OCT2 tak vyvolá zvýšení plazmatických koncentrací metforminu pravděpodobně spojené se zvýšením rizika vzniku laktátové acidózy.
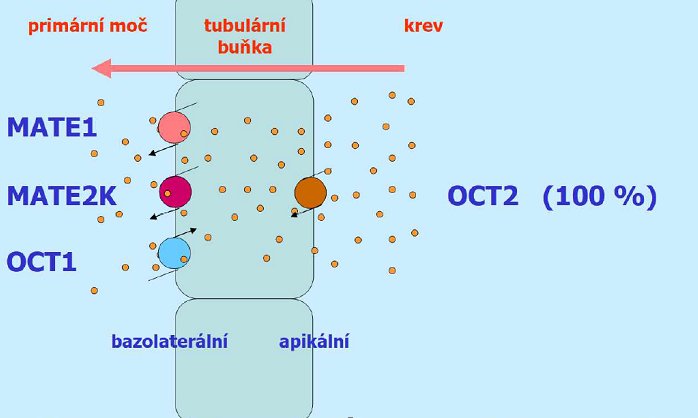
Obrázek č. 45
Schéma role jednotlivých transportních systémů při eliminaci metforminu ledvinami
Též role OCT1 a OCT3 je zásadně významná pro zajištění klinického efektu metforminu3. Vstup metforminu do jaterní buňky je zajištěn právě těmito dvěma transportními systémy.
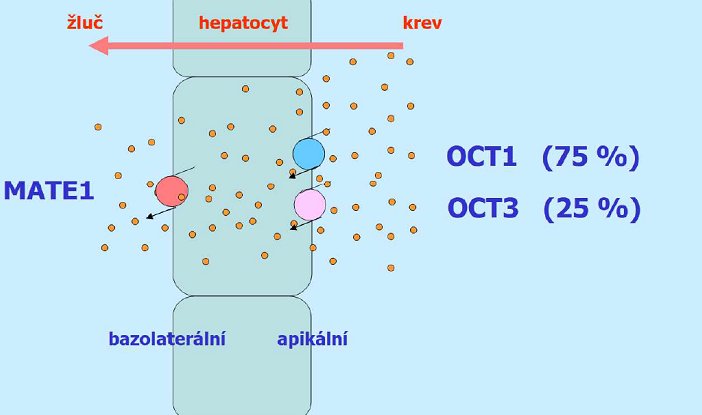
Obrázek č. 46
Schéma role jednotlivých transportních systémů při vstupu metforminu do jaterní buňky
Vstup do svalové buňky je pak zajištěn výhradně OCT33.
Inhibitory OCT1, OCT2 a OCT3 se do značné míry překrývají. Mezi středně silné až silné inhibitory OCT2 patří:
- dolutegravir,
- cimetidin,
- ranolazin,
- vantedanib.
Mezi slabé inhibitory OCT2 patří:
- PPI,
- fampridin,
- naringin,
- ritonavir,
- olaparib,
- krizotinib.
Tato léčiva zpomalují eliminaci metforminu, zvyšují jeho plazmatické koncentrace bez vlivu na zvýšení účinnosti, zvyšují riziko laktátové acidózy. Nutno však doplnit, že řada z těchto léčiv vedle inhibice OCT2 dále inhibuje MATE, čímž se jejich vliv na zpomalení eliminace metforminu dále prohlubuje. Nejvyšší inhibiční efekt na OCT2 má pravděpodobně dolutegravir, který se používá ke kombinované antiretrovirové terapii HIV. Při podávání dolutegraviru v dávkách 50 mg 1krát denně (tj. v obvyklé terapeutické dávce) dochází ke zvýšení plochy pod křivkou metforminu o 79 % a zvýšení jeho maximálních plazmatických koncentrací o 66 %. Při zvýšení dávky dolutegraviru na 50 mg 2krát denně (obvyklá dávka dolutegraviru při jeho kombinaci s např. efavirenzem) dochází ke zvýšení plochy pod křivkou metforminu o 145 % a zvýšení jeho maximálních plazmatických koncentrací o 111 %[1].
Expozici metforminu zvyšují další inhibitory OCT2 jako je např. ranolazin[2] (o 79 %), vandetanib[3] ( o 75 %), pyrimethaminu[4] (o 138 %) nebo trimethoprimu[5] (o 37 %).
Expozici metforminu však mohou zvýšit též induktory OCT1, protože vyšší aktivita tohoto transportního systému zvyšuje biologickou dostupnost metforminu. Současné podávání metforminu s induktorem OCT1 rifampicinem tak vede ke zvýšení plochy pod křivkou metforminu o 13 %, avšak ke snížení maximální glykémie o 42 % (p=0,024)[6].
Mezi středně silné inhibitory OCT3 patří systémově podávané glukokortikoidy. Mezi slabé inhibitory OCT3 patří:
- PPI,
- cimetidin,
- berberin,
- rifampicin,
- prazosin,
- estradiol.
Tato léčiva mohou snižovat klinický efekt metforminu, neboť snižují vstup metforminu do svalové buňky, v důsledku čehož nedochází ke zvýšení citlivosti těchto buněk na insulin (nedochází ke zvýšení vychytávání glukózy) a současně snižují vstup metforminu do jaterní buňky, čímž se snižuje jeho efekt na snížení glukoneogeneze a inhibici glykogenolýzy.
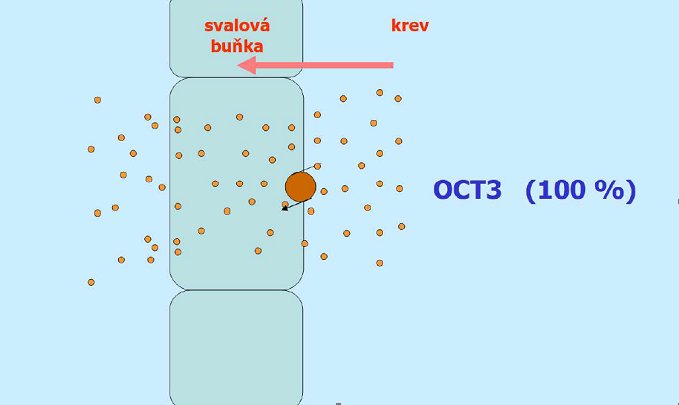
Obrázek č. 47
Schéma role jednotlivých transportních systémů při vstupu metforminu do svalové buňky
Ke kontroverzním lékovým interakcí metforminu na podkladě inhibice transportních systémů OCT patří interakce s inhibitory protonové pumpy. Všechna tato léčiva patří mezi polyfunkční inhibitory OCT1, OCT2 i OCT3. Vliv inhibitorů protonové pumpy na farmakokinetické vlastnosti metforminu je však na první pohled zanedbatelný. Důvodem je skutečnost, že sice snižují eliminaci metforminu ledvinami (inhibice OCT2), ale současně snižují biologickou dostupnost metforminu (inhibice OCT1 a OCT3).
Současné podávání omeprazolu a metforminu tak vede ke zvýšení plochy pod křivkou metforminu o pouhých 18 %. K mírnému zvýšení plochy pod křivkou metforminu dochází též v případě pantroprazolu o 16 %[7], rabeprazolu o 22 %13, lansoprazolu o 17 %[8] a esomeprazolu14. Hypoglykemický efekt metforminu, stejně jaké jeho vliv na hodnoty glykovaného hemoglobinu, se současným podáváním inhibitorů protonové pumpy nemění[9]. Avšak z údajů z prospektivní kohortové studie vyplývá, že současné podávání metforminu a inhibitorů protonové pumpy vede ke zvýšení mortality/hospitalizace pro kardiovaskulární příhodu dosahujícího rizika 1,55 (1,46-1,64 na 95% hladině spolehlivosti), zatímco současné podávání metforminu a inhibitorů H2-receptorů (ranitidin, famotidin) ke statisticky významnému zvýšení rizika úmrtí/hospitalizace nevede, riziko v tomto případě činí 1,29 (0,97-1,70 na 95% hladině spolehlivosti).
Výrobce metforminu v ČR[10] a SR[11] uvádí: metformin je substrátem pro oba transportéry OCT1 a OCT2. Souběžné podávání metforminu s inhibitory OCT1 (jako je verapamil) může snížit účinnost metforminu. Souběžné podávání metforminu s induktory OCT1 (jako je rifampicin) může zvýšit gastrointestinální absorpci a účinnost metforminu. Souběžné podávání metforminu s inhibitory OCT2 (jako je cimetidin, dolutegravir, ranolazin, trimethoprim, vandetanib, isavukonazol) může snížit renální vylučování metforminu, což povede ke zvýšení koncentrace metforminu v plazmě. Souběžné podávání metforminu s inhibitory obou OCT1 a OCT2 (jako krizotinib, olaparib) může ovlivnit účinnost a renální eliminace metforminu. Opatrnost je proto doporučována, a to zejména u pacientů s poruchou funkce ledvin, kdy tyto léky jsou podávány současně s metforminem, protože koncentrace metforminu v plazmě se může zvýšit. Jestliže je potřebné, úprava dávky metforminu může být zvažována, jelikož inhibitory/induktory OCT mohou mít vliv na účinnost metforminu.
Lékové interakce vzniklé v důsledku inhibice konečné fáze eliminace
Zajímavé je, že se výrobce metforminu v ČR a SR nevyjadřuje k problematice transportních systémů MATE. Jak již bylo uvedeno hrají při konečné fázi eliminace metforminu významnou roli transportní systémy MATE-1 a MATE-2K.
Mezi silné inhibitory MATE-1 patří pyrimethamin a trimetoprim. Mezi slabé až středně silné inhibitory MATE-1 patří:
- ranitidin,
- ondansetron,
- verapamil,
- chinidin,
- ciprofloxacin,
- dihydropyridinové kalciové blokátory.
Mezi silné inhibitory MATE-2K patří:
- pyrimethamin,
- trimetoprim,
- cimetidin,
- gatifloxacin.
Mezi slabé až středně silné inhibitory MATE-2K patří:
- levofloxacin,
- ciprofloxacin.
Též inhibitory MATE-1 a MATE-2K, stejně jako inhibitory OCT2, mohou vést ke zvýšení expozice metforminu a zvýšení rizika nežádoucích účinků, zejména laktátové acidózy.
V souvislosti s lékovými interakce metforminu je nezbytné upozornit na jeho podávání pacientům, kteří se mají podrobit RTG vyšetření s aplikací jodované kontrastní látky. Dosud bylo ve světové odborné literatuře popsáno pouze 18 kasuistik vzniku renálního selhání a laktátové acidózy při současném podávání metforminu a kontrastních médií. Z toho se v 15ti případech jednalo o pacienty s poruchou funkce ledvin nebo kontraindikací podávání metforminu. V doporučeních Royal College of Radiologists se uvádí, že před každou aplikací kontrastních médií u pacientů léčených metforminem je nezbytně nutné vyšetření stavu renálních funkcí. V případě zjištění snížené funkce ledvin je aplikace kontrastního média kontraindikovaná[12]. Výrobce metforminu v ČR a SR se k aplikaci jodovaných RTG kontrastních látek vyjadřuje následovně: metformin musí být vysazen před nebo v době provedení zobrazovacího vyšetření a jeho podávání nesmí být znovu zahájeno nejméně 48 hodin po provedení vyšetření za předpokladu, že byla znovu vyhodnocena renální funkce a bylo zjištěno, že je stabilní.
Kasuistika
Pacient ve věku 71 roků diabetik 2. typu, s mírnou poruchou funkce ledvin, léčený monoterapií metforminem v dávkách 850 mg 2krát denně, byl pro nefrolithiázu indikován k provedení RTG kontrastního vyšetření s použitím metrizamidu[13]. Po aplikaci došlo k akutnímu selhání ledvin a vzniku laktátové acidózy. Byla zahájena intenzivní terapie zahrnující krátkodobě prováděnou hemodialýzu, aplikaci furosemidu a infuzi krystaloidů. Po přibližně 96 hodinách se stav upravil a pacient byl propuštěn do domácího ošetřování.
Na výskyt nežádoucích účinků metforminu je nezbytné myslet. V ČR bylo v roce 2016 v rámci spontánních hlášení oznámeno SÚKL celkem 33 nežádoucích účinků v souvislosti s podáváním metforminu[14]. Z toho byl metformin podáván v monoterapii v 17 případech a metformin v kombinaci s jinými antidiabetiky byl podáván v 16 případech. Laktátová acidóza byla hlášena celkem 4krát (z toho v 1 případě bylo zaznamenáno úmrtí pacienta). Symptomatická hypoglykémie byla hlášena celkem 11krát, i když sám metformin k hypoglykémii nevede. Při odhadovaném hlášení 1-5 % případů, by skutečný výskyt nežádoucích účinků metforminu mohl být mezi 660 až 3 300 případy ročně, což by při 294 000 léčených pacientech (dle údajů o spotřebě v DDD/TID) v roce 2016 představovalo incidenci 0,2-1,12 %.
Klinicky významné lékové interakce metforminu:
|
lékové interakce metforminu |
||
|
léčivo |
důsledek |
celková závažnost |
|
citalopram |
snížení biologické dostupnosti, GIT intolerance |
středně závažná |
|
co-trimoxazol |
snížení eliminace, zvýšení rizika laktátové acidózy |
středně závažná |
|
dolutegravir |
snížení eliminace, zvýšení rizika laktátové acidózy |
závažná |
|
doxazosin |
snížení biologické dostupnosti, GIT intolerance |
málo závažná |
|
escitalopram |
snížení biologické dostupnosti, GIT intolerance |
středně závažná |
|
esomeprazol |
snížení biologické dostupnosti, GIT intolerance, snížení eliminace metforminu ledvinami, mírné zvýšení mortality |
málo až středně závažná |
|
hydrochlorothiazid |
snížení účinku metforminu, zejména dávky 25 mg denně a vyšší (zvýšení glykémie nalačno průměrně o 0,6 mmol/l) |
středně závažná |
|
isavukonazol |
snížení eliminace, zvýšení rizika laktátové acidózy |
středně závažná |
|
jodovaná RTG média |
zhoršení renálních funkcí, laktátová acidóza |
kontraindikace |
|
kodein |
snížení biologické dostupnosti, GIT intolerance |
středně závažná |
|
lansoprazol |
snížení biologické dostupnosti, GIT intolerance, snížení eliminace metforminu ledvinami, mírné zvýšení mortality |
málo až středně závažná |
|
olaparib |
snížení biologické dostupnosti, GIT intolerance |
středně závažná |
|
omeprazol |
snížení biologické dostupnosti, GIT intolerance, snížení eliminace metforminu ledvinami, mírné zvýšení mortality |
málo až středně závažná |
|
ondansetron |
snížení biologické dostupnosti, GIT intolerance |
středně závažná |
|
ostatní antidiabetika |
možnost hypoglykémie |
nezávažná |
|
pantoprazol |
snížení biologické dostupnosti, GIT intolerance, snížení eliminace metforminu ledvinami, mírné zvýšení mortality |
málo až středně závažná |
|
pyrimethamin |
snížení eliminace, zvýšení rizika laktátové acidózy |
středně závažná |
|
rabeprazol |
snížení biologické dostupnosti, GIT intolerance, snížení eliminace metforminu ledvinami, mírné zvýšení mortality |
málo až středně závažná |
|
ranolazin |
snížení eliminace, zvýšení rizika laktátové acidózy |
středně závažná |
|
rifampicin |
zvýšení biologické dostupnost, zvýšení rizika laktátové acidózy |
středně závažná |
|
safinamid |
snížení biologické dostupnosti, GIT intolerance |
středně závažná |
|
trimethoprim |
snížení eliminace, zvýšení rizika laktátové acidózy |
středně závažná |
|
vandetanib |
snížení eliminace, zvýšení rizika laktátové acidózy |
středně závažná |
|
verapamil |
snížení biologické dostupnosti, GIT intolerance |
středně závažná |
Literatura:
[1] UKPDS Group: Lancet 1998; 352 (9131): 854-865
[2] Lamanna C et al: Diabetes Obes Metabol 2011; 13: 221-228
[3] Kim AH et al: Drug Metabol Disp 2014; 42: 1174-1179
[4] Yee SW et al: J Pharmacokinet Pharmacodyn 2015; 42: 463-475
[5] Dujic T et al: Diabetes Care 2016; 39: 1896-1901
[6] Ahlin G et al: Pharmacogenomics J 2011; 11: 400-411
[7] Song IH et al: J Acquir Immune Defic Syndr 2016; 72: 400-407
[8] Zack J et al: Clin Pharmacol Drug Dev 2015; 4: 121-129
[9] Johansson S et al: Clin Pharmacokinet 2014; 53: 837-847
[10] Kusuhara H et al: Clin Pharmacol Ther 2011; 89: 837-844
[11] Grün B et al: Br J Clin Pharmacol 2013; 76: 787-796
[12] Cho SK et al: Clin Pharmacol Ther 2011; 89: 416-421
[13] Kim A et al: Drug Metab Dispos 2014; 42: 1174-1179
[14] Ding Y et al: Eur J Clin Pharmacol 2014; 70: 141-146
[15] Flory J et al: Br J Clin Pharmacol 2015; 79: 330-336
[16] SPC ČR: Glucophage® (metformin), Merck, 4/2016 (http://www.sukl.cz/modules/medication/download.php)
[17] SPC SR: Glucophage® (metformin), Merck, 4/2015 (http://www.sukl.sk/buxus/docs/download/SPC00361933.doc)
[18] The Royal College of Radiologists. Guidelines with regard to metformin-induced lactic acidosis and x-ray contrast medium agents. 19th March 1999
[19] Safadi R et al: Am J Nephrol 1996; 16: 520-522
[20] Nežádoucí účinky léčiv, 3/2017 (www.sukl.cz)
